Contenu
La chaleur spécifique, la chaleur sensible et la chaleur latente sont des quantités physiques:
le chaleur spécifique d'une substance est la quantité de chaleur qui doit être fournie à une unité de masse de cette substance pour élever sa température d'une unité. Cette quantité varie considérablement en fonction de la température à laquelle se trouve la substance avant que la chaleur ne lui soit appliquée. Par exemple, il faut une calorie pour augmenter d'un degré l'eau à la température ambiante, mais seulement 0,5 calorie pour augmenter la température de la glace à -5 degrés d'un degré. La chaleur spécifique dépend également de la pression atmosphérique. La même substance à une pression atmosphérique inférieure a une chaleur spécifique inférieure. Les exemples ci-dessous sont valables pour une température de 25 degrés et une pression de 1 atmosphère.
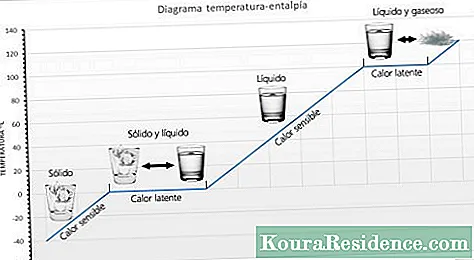
le chaleur sensible C'est la quantité de chaleur qu'un corps peut recevoir sans affecter sa structure moléculaire. Si la structure moléculaire ne change pas, l'état (solide, liquide, gaz) ne change pas. Puisque la structure moléculaire ne change pas, on observe un changement de température, c'est pourquoi on l'appelle chaleur sensible.
le chaleur latente est l'énergie (chaleur) nécessaire pour qu'une substance change de phase (état). Si le changement se fait du solide au liquide, on parle de chaleur de fusion. Si le changement se fait de liquide en gazeux, on parle de chaleur de vaporisation. Lorsque la chaleur est appliquée à une substance qui a atteint la température à laquelle elle change d'état, il est impossible que la température augmente, elle change simplement d'état. Par exemple, si la chaleur continue à être appliquée à l'eau bouillante, elle ne dépassera jamais 100 ° C. Selon la substance, la chaleur latente peut généralement être mesurée en calories par gramme ou en kilojoules par kilogramme (KJ).
Exemples de chaleur spécifique
- Eau (à l'état liquide): 1 Calorie par gramme pour augmenter de 1 ° C
- Aluminium: 0,215 calorie par gramme
- Béryllium: 0,436 calorie par gramme
- Cadmium: 0,055 calorie par gramme
- Cuivre. 0,0924 calorie par gramme
- Glycérine: 0,58 calorie par gramme
- Or: 0,0308 calorie par gramme
- Fer: 0,107 calorie par gramme
- Plomb: 0,0305 calorie par gramme
- Silicium: 0,168 calories par gramme
- Argent: 0,056 calorie par gramme
- Potassium: 0,019 calorie par gramme
- Toluène: 0,380 calorie par gramme
- Verre: 0,2 calorie par gramme
- Marbre: 0,21 calorie par gramme
- Bois: 0,41 calorie par gramme
- Alcool éthylique: 0,58 calorie par gramme
- Mercure: 0,033 calorie par gramme
- Huile d'olive: 0,47 calories par gramme
- Sable: 0,2 calorie par gramme
Exemples de chaleur sensible
- Chauffez de l'eau entre 1 et 100 ° C
- Appliquez de la chaleur sur l'étain à moins de 240 ° C
- Appliquez une chaleur de plomb inférieure à 340 ° C
- Appliquez de la chaleur sur du zinc en dessous de 420 ° C
- Appliquez de la chaleur sur l'aluminium à moins de 620 ° C
- Appliquez de la chaleur sur le bronze à moins de 880 ° C
- Appliquez de la chaleur sur du nickel inférieur à 1450 ° C
Exemples de chaleur latente
Eau: chaleur latente de fusion: 80 calories par gramme (il faut 80 calories pour un gramme de glace à 0 ° C pour devenir de l'eau), chaleur latente de vaporisation: 540 calories par gramme (il faut 540 calories pour un gramme) d'eau à 100 ° C pour devenir vapeur).
Acier: chaleur latente de fusion: 50 calories
Alumino: chaleur latente de fusion: 85 calories / 322-394 KJ; chaleur latente de vaporisation: 2300 KJ.
Soufre: chaleur latente de fusion: 38 KJ; chaleur latente de vaporisation: 326 KJ.
Cobalt: chaleur latente de fusion: 243 KJ
Cuivre: chaleur latente de fusion: 43 calories; chaleur latente de vaporisation: 2360 KJ.
Étain: chaleur latente de fusion: 14 calories / 113 KJ
Phénol: chaleur latente de fusion: 109 KJ
Fer: chaleur latente de fusion: 293 KJ; chaleur latente de vaporisation: 2360 KJ.
Magnésium: chaleur latente de fusion: 72 calories
Mercure: chaleur latente de fusion: 11,73 KJ; chaleur latente de vaporisation: 356,7 KJ.
Nickel: chaleur latente de fusion: 58 calories
Argent: chaleur latente de fusion: 109 KJ
Plomb: chaleur latente de fusion: 6 calories; chaleur latente de vaporisation: 870 KJ.
Oxygène: chaleur latente de fusion: 3,3 calories
Or: chaleur latente de fusion: 67 KJ
Zinc: chaleur latente de fusion: 28 calories


